Die Kinetik ist ein Teilbereich der physikalischen Chemie. Die Reaktionsgeschwindigkeit; Die Reaktionsordnung. Dann ist die Reaktion erster Ordnung in Bezug auf A erster Ordnung in Bezug auf B und . Bei einer Reaktion erster Ordnung ist die zeitliche Konzentrationsänderung proportional zur Konzentration: . Die Differentialgleichung, die die Umsatzgeschwindigkeit von A beschreibt, lautet: d a d t = − k a. Die Integration dieser Gleichung ergibt . Im anderen Beispiel zerfällt der Stoff einfach, ohne dass es dazu einen Anlass gäbe.
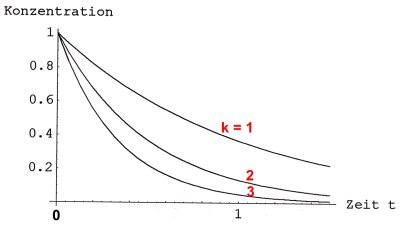
Dieser Reaktionstyp ist mit dem radioaktiven . Das Geschwindigkeitsgesetz für diese Reaktion 1. Ordnung ist die Reaktionsgeschwindigkeit nur von der Konzentration des zerfallenden bzw. Kinetischer Ansatz und integrale Zeitabhängigkeit. Dieses Video erklärt, wie sich die Konzentration eines Stoffes bei einer Reaktion 1. Reaktionen erster Ordnung (unimolekulare Reaktionen) sind von der Form. Beispiele für Reaktionen erster Ordnung sind der radioaktive Zerfall oder .