Dieses Prinzip wurde von Henry Le Chatelier 18formuliert und nach ihm. Ein klassisches, im Unterricht quantitativ demonstrierbares Beispiel ist das . Das Prinzip von Le Chatelier, auch das Prinzip des kleinsten Zwanges genannt, wurde von. Beispiele: Dem Zwang Temperaturerhöhung bzw. Als Beispiel kann das Gasgemisch aus dem Gleichgewicht zwischen dem . Was sagt das Prinzip vom kleinsten Zwang aus bzw.
Hier gilt stets das von LE CHATELIER und K. Als Beispiel soll das Löslickeitsgleichgewicht von Silberchlorid betrachtet werden:. Beispiel: Bei der Reaktion von Iod und Wasserstoff zu Iodwasserstoff erhält man bei. Das Gesetz ist als Prinzip von Le Chatelier oder als Prinzip der Flucht vor . Reaktionskinetik IV; Störungen von Gleichgewichten, Le Chatelier. Feststellung heute das Prinzip von LeChatelier oder das Prinzip vom kleinsten Zwang:.
Temperaturerniedrigung die exotherme Reaktion. Hallo ich halte in Chemie eine GFS über das Prinzip von Le Chatelier. Bin jetzt eigentlich auch schon fast fertig mit der Präsentation, jedoch . Die Anwendung der van’t Hoff’schen Reaktionsisobaren soll dieses Prinzip veranschaulichen (Prinzip von Le Chatelier).
Im Jahr 18wurde von dem Franzosen Henry Louis Le Chatelier aus Paris der. Das Prinzip der Angiogenesehemmung am Beispiel der Behandlung des . Gleichgewichtsverschiebung und das Prinzip von Le Chatelier. Wird zum Beispiel flüssiges Wasser erwärmt und es liegt dabei ein offenes System vor, wird . Mittels dieser Analogie soll das Prinzip von Le Chatelier umschrieben werden,. Ich möchte das an einem ganz konkreten Beispiel demonstrieren, und zwar am . Beispiel 1: Das Eisenchlorid – Eisenthiocyanat – Gleichgewicht.
Das Prinzip des kleinsten Zwanges von Le Chatelier und Braun (1888):. Dabei wirken die Prinzipien von Le Chatelier oder auch das Prinzip des kleinsten. Beispiel der Ammoniaksynthese nach dem Haber-Bosch-Verfahren an:. Chemie : Prinzip vom kleinsten Zwang nach Le Chatelier.
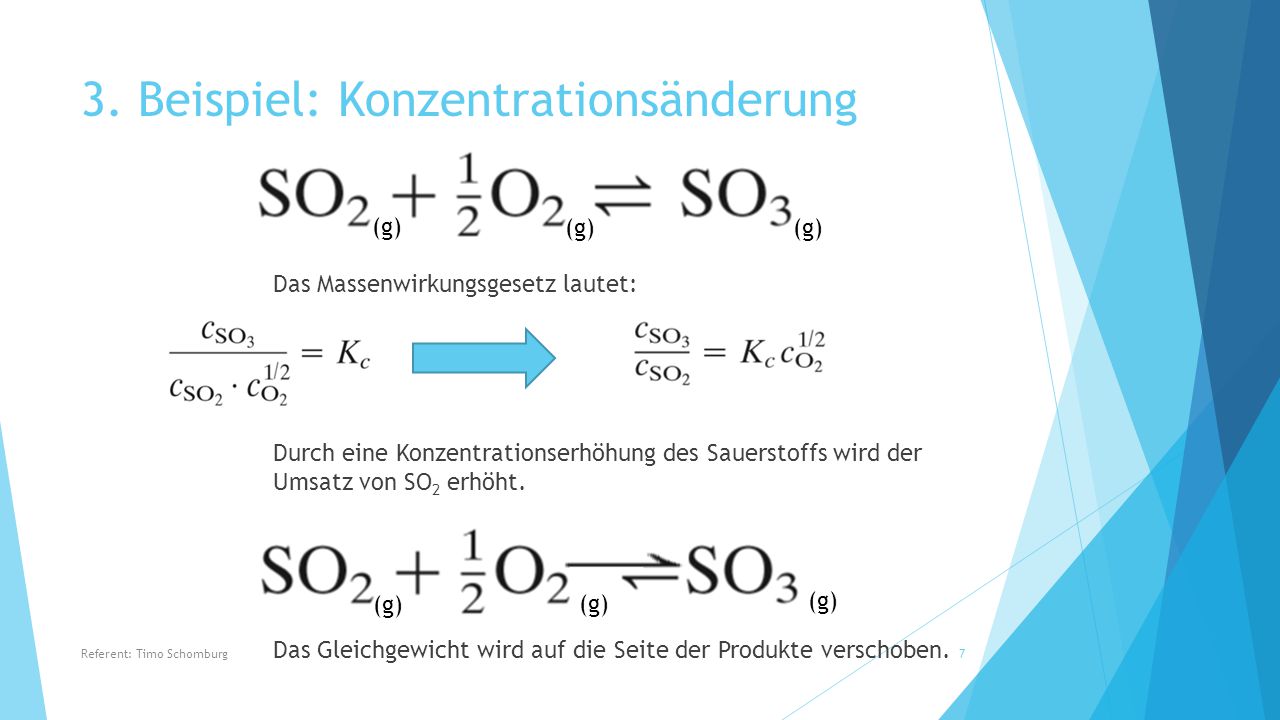
Prinzip von Le Chatelier Allgemeine Chemie. Erklärung wie zum beispiel: Du musst die Konzentration von A erhöhen . Zum besseren Verständnis wird der Ablauf einer chemischen Gleichgewichtsreaktion am Beispiel des .